1. 1.5 mL エッペンチューブを用意し,以下の試薬を混合して mCherry cDNA を切り
出すための反応液を作る。
H2O (プラスミドと水で計 7 μL になるように)
2〜6 μL
pCR II-mCherry (自分で用意したプラスミド)
1〜5 μL
10x 制限酵素バッファー (a)
1 μL 10x ウシ血清アルブミン (b)
1 μL BamHI (c)
0.5 μL XhoI (d)
0.5 μL
1. 1.5 mL エッペンチューブを用意し,以下の試薬を混合して pBluescript II SK+ から
EGFP cDNA を切り捨てるための反応 液を作る。
H2O (プラスミ ドと水で計 7 μL になるように) 2〜6 μL
SK+EGFP (自分で用意したプラスミド)
1〜5 μL 10x 制限酵素バッファー (a)
1 μL 10x ウシ血清アルブミン (b)
1 μL BamHI (c)
0.5 μL XhoI (d)
0.5 μL
注: プラスミドはそれぞれどれだけの長さの何本 の断片に切れるか,あらかじめ確認
しておくこと。
2. 反応液をよく混ぜて,37℃ で約 1 時間,反応させる。
注: 制限酵素はタンパク質なので,凍結融解を繰り返すと 立体構造が壊 れて活性
が落ちます。そこで,-30℃ の冷凍庫で凍らないように(また,タンパクが安定に
保たれるように) 50% のグリセリンを含むバッファーに溶か してあります。その
ため,反応液に酵素を入れると酵素はすぐに反応液に混ざらずに底に沈みます。
反応液を作ったときによく混ぜないと反応が進まないので注意。
3. 反応液 10 μL に対して 2 μL の 6x 色素溶液を加えて,全量を電気泳動する。
電気泳動については,次のセクションへ。。。
10x というのは,反応液中の最終濃度に対して 10 倍の濃度・・・すなわち,10 倍濃縮(b) 10x ウシ血清アルブミン
という意味。メーカーによって組成に多少の違いがあるが,例えば New England Biolabs
社 が BamHI 用に奨める 10x バッファーの組成は [500 mM Tris-HCl (pH 7.9),1000 mM
NaCl,100 mM MgCl2,10 mM dithiothreitol (DTT)]。XhoI 用のは [200 mM Tris-acetate
(pH 7.9),500 mM potassium acetate,100 mM MgCl2,10 mM DTT]。両者の組成は
異なるが,XhoI は BamHI 用のバッファーでも (どんなバッファーでも) よく切れるうえに
異なるバッファーでも Star 活性が出にくい。一方,BamHI はバッファーの組成が変わると
とても Star 活性が出やすい。したがって,今回の実習では BamHI 用のバッファーを使い,
両方の酵素で同時に切断する。
1 mg/mL のウシ血清アルブミンを使う。反応液中の制限酵素は低濃度になるが,ウシ(c) BamHI
血清アルブミンを混ぜておくと酵素タンパクの安定性が増す。酵素によっては添加不要
なのだが,ウシ血清アルブミンを添加することによって活性が阻害されるような制限酵素
はないので(必要か不要かをいちいち考えるのが面倒なので),大抵はウシ血清アルブミン
を含む反応液を作る。
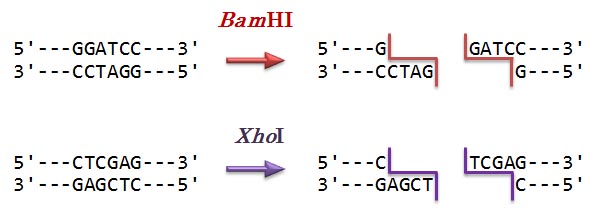
Bacillus amyloliquefaciens H という細菌起源。認識配列は [5'-G/GATCC-3']。(d) XhoI
Bam というのは属名の頭 1 文字と種名の頭 2 文字をとったもの。このように,制限酵素
の名前の頭 3 文字は学 名 (ラ テン語) に由来するのでイタリックで書く。 4 文字め以降は
イタリックにしない。ちなみに,DNA 上の認識配列を表記するときには BamHI はイタリック
にしない。 BamHI は高濃度のグリセリン,Mn2+ の存在,低イオン強度下で Star 活性が
出ることが知られている。
Xanthomonas holcicola という細菌由来。認識配列は [5'-C/TCGAG-3']。