各グループの total RNA 水溶液をアガロースゲルで電気泳動した。M のレーンで泳動したマーカーは,二重鎖 DNA のマーカーであるため,
RNA の鎖長を判定する物差しとしては使えないので注意すること。
ただし,光の強さ(白くみえる部分)はそこにある核酸の量を反映していると考えてよい。強い光,太いバンドはそれだけ核酸の量が多い。
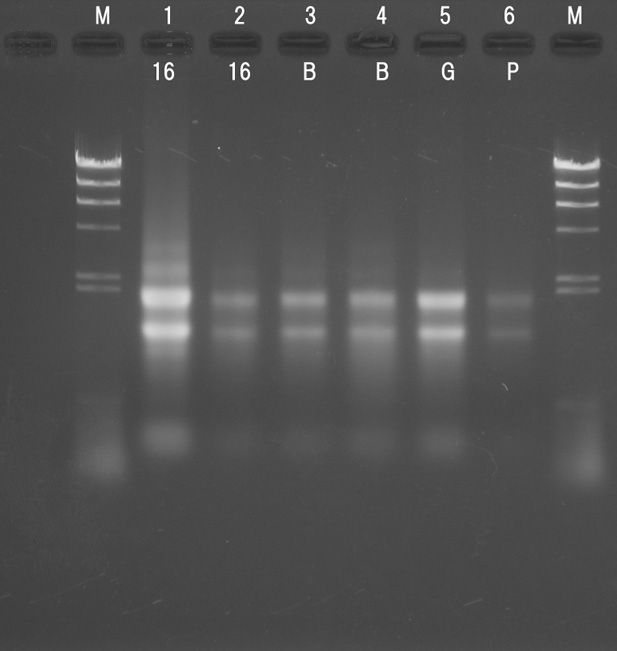
※ 1,4,5,6 班の RNA から作製した cDNA を RT-PCR の鋳型として使用した
★ 結果 ★
-吸光度測定による定量および純度測定
測定のために超純水で希釈しましたので,表示の数値は希釈後の RNA の濃度です。
以下の値は,機器(バイオフォトメータ)に表示された値である。
| . | . | 値 1 回目 | 希釈 | 発生段階 | 電気泳動量 |
| 1 班 | 濃度 (ng/uL) | 63 | 1/10. | 16 細胞期 (16) |
1000 ng 計算. (1 ug) . |
| A260/A280 | 2.06 | . | |||
| 2 班 | 濃度 (ng/uL) | 76 | 1/10. | ||
| A260/A280 | 2.12 | . | |||
| 3 班 | 濃度 (ng/uL) | 73 | 1/10. | 胞胚期 (B) |
|
| A260/A280 | 1.86 | . | |||
| 4 班 | 濃度 (ng/uL) | 54 | 1/10. | ||
| A260/A280 | 1.74 | . | |||
| 5 班 | 濃度 (ng/uL) | 67 | 1/5. | 原腸胚期 (G) |
|
| A260/A280 | 2.06 | . | |||
| 6 班 | 濃度 (ng/uL) | 15 | 1/5. | プルテウス幼生 (P) |
200 ng 計算. (0.2 ug) . |
| A260/A280 | 1.97 | . | |||
| . | 濃度 (ng/uL) | . | . | . | |
| A260/A280 | . | . | |||
| . | 濃度 (ng/uL) | . | . | ||
| A260/A280 | . | . | |||
| . | . | . | . | . | . |
-アガロースゲル電気泳動
各グループの total RNA 水溶液をアガロースゲルで電気泳動した。M のレーンで泳動したマーカーは,二重鎖 DNA のマーカーであるため,
RNA の鎖長を判定する物差しとしては使えないので注意すること。
ただし,光の強さ(白くみえる部分)はそこにある核酸の量を反映していると考えてよい。強い光,太いバンドはそれだけ核酸の量が多い。

※ 1,4,5,6 班の RNA から作製した cDNA を RT-PCR の鋳型として使用した
★ レポート作成のポイント
実験結果の説明として,上記の吸光度計での測定値と電気泳動写真を使用し,抽出した RNA のクオリティチェック (QC)を自分たちで
やってみてください。
自分たちの班の RNA の品質を中心に述べるのが基本ですが,他班の結果も材料にして,濃度と電気泳動像のつじつまが合っているか
どうかなど,考察してみてください。A260/A280 とは何なのか?調べてみると一段深い考察ができるかもしれません。
★ 課題1
今回の実習でやったアガロースゲル電気泳動では,TAE バッファーにアガロース(1% w/v)を溶かして,型に流し込み,冷やして固めたゲルを使い,
TAEバッファー中で電気泳動しました。しかし,この方法では,RNA を正しく鎖長ごとに分離することができません。
そこで,この課題では,,「正しい方法」を自学で理解してもらいます。RNA をゲル電気泳動で分離する正しい方法について,説明してください。
ただし,「○×○×法」のように単語で答えるのではなく,RNA の性質などについても触れながら,手順や使われる試薬などが
「何ための手順なのか?」「その試薬にどんな効果があるのか?」が分かるように,でもなるべく簡潔に記述してください。
2) 逆転写反応による cDNA 合成へ
3) RT-PCRへ
TOPへ