2. 部位特異的突然変異の導入
はじめに (Kunkel 法による部位特異的突然変異導入法・・・2)
Kunkel 法による突然変異の導入の次の段階は、合成オリゴヌクレオチドを用いた
in vitro
での DNA 合成です。合成オリゴヌクレオチドは、好みの配列のものを受託合成します。
(1 塩基 60 円くらいで望みどおりの配列のオリゴヌクレオチドを合成してもらえます。)
オリゴヌクレオチドは、前の段階で作った 1 本鎖 DNA に相補的な(塩基対を形成できる)
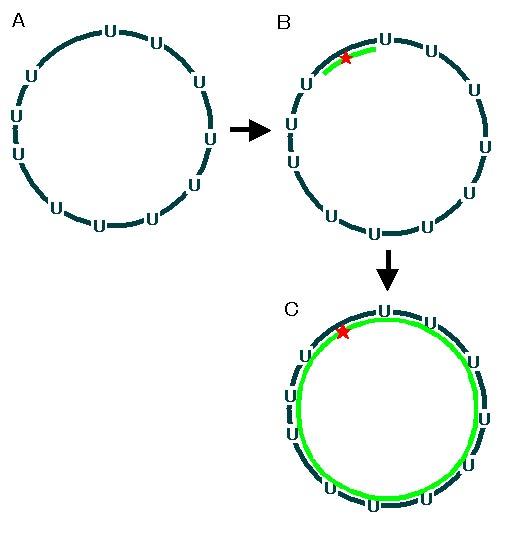
鎖でなければいけません(図 1A-B)。図 1B ではオリゴヌクレオチドを黄緑で表して
あります。オリゴヌクレオチドに星印が付いているのに気づきましたか?この星印が
変異を導入したい箇所です。この部分は、ですから、ウラシルを含むオリジナルの DNA
とは違う配列になり、オリゴヌクレオチドのこの部分と 1 本鎖鋳型 DNA にはミスマッチが
あることになります(具体的なことは後述)。実際の作業としては、まずオリゴヌクレオチドを
含ウラシル 1 本鎖 DNA とアニーリングさせます。その後、このオリゴヌクレオチドを
プライマーとして T4 DNA polymerase によって相補鎖を合成します(図 1C)。
仕上げに T4 DNA ligase で途切れている部分をつなぎ合わせると完成です。ウラシルを
含むオリジナルの鎖にはもちろん変異は入っていませんが、in vitro で新たに合成された
鎖には星印の部分に変異が入っています。DNA 合成反応液には dATP、dCTP、dGTP、
そして dTTP だけが入っていて、dUTP は入っていませんので、こちらにはウラシルは
まったく含まれないことに注意してください。この 2 本鎖プラスミドを、通常の大腸菌の
系統(例えば DH5α)に導入すると、ウラシルをたっぷり含む鎖の方はぼろぼろに
壊されて消えていきますが、変異の入った鎖の方はきちんと複製されて大腸菌の増殖と
ともに増えていくのです。
図 1 
In vitro での DNA 合成の後、DH5α 系統の大腸菌にプラスミドを導入して、アンピシリン
を含む寒天培地で培養をすると、できてきたコロニーの大多数は、変異型の cDNA が
組み込まれたプラスミドを持っていることを期待できます。
知っておかなければならないこと
オリゴヌクレオチドは、生物の行うのとは違った経路で化学合成されます。その結果、変異導入の計画
前にも一度出てきましたが EGFP の配列を見てください。実験
オリゴヌクレオチドの 5' リン酸化:1. オリゴヌクレオチド(100 pmol/μL) を 2 μL とり、滅菌水 (a) と混ぜてオリゴヌクレオチドのアニーリング:
52.5 μL とする。
注: Y67H と Y146F は、2 μL ずつ。 S148P は単独で 2 μL 使う。
2. 以下のものを加える(全量が 60 μL になる)。
10x T4 polynucleotide kinase 用バッファーを 6 μL
[500 mM Tris-HCl (pH 8.0), 100 mM MgCl2, 100 mM 2-mercaptoethanol]
100 mM ATP (b) を 0.5 μL
T4 polynucleotide kinase (c) (10 units/μL) を 1 μL
3. 反応液を 37℃ に 45 分間おき、その後、酵素を失活させるために
65℃ で 10 分間の熱処理を行う。
4. 0.5 mL チューブ(PCR 用)を用意し以下のものを混ぜる。変異 DNA 合成:
アニーリングバッファーを 1 μL
[200 mM Tris-HCl (pH 7.5), 20 mM MgCl2, 500 mM NaCl]
含ウラシル 1 本鎖 DNA を 1〜2 μL
リン酸化オリゴヌクレオチドプライマー(前のステップの反応液)を 1.5 μL
滅菌水を加えて合計 7 μL とする。
5. 70℃ で 5 分間おいた後、30 分間ほどかけてゆっくりと 40℃ 程度まで
冷やす。
この作業は、PCR 用のサーマルサイクラーを用いて行う。
6. アニーリングの終わった反応液に以下のものを混ぜる。
10x 合成バッファーを 1 μL
[4 mM dNTP, 7.5 mM ATP, 175 mM Tris-HCl (pH 7.5), 37.5 mM MgCl2,
5 mM dithiothreitol]
T4 DNA polymerase (d) (7 units/μL)を 1 μL
T4 DNA ligase (e) (3 units/μL)を 1 μL
7. 氷の上に 5 分間、25℃ で 5 分間、つづいて 37℃ で 90 分間おく。
この作業もサーマルサイクラーで行う。
8. 反応液に TE を 40 μL 加えて、そのうちの 5 μL を用いて、大腸菌
DH5α 系統の competent cells (50 μL)のトランスフォーメーション
を行う。
作業の手順は、CJ236 のときと同様だが、今回は competent cells を
50 μL 使うので注意。
9. 全量を LB/amp 寒天培地に塗りひろげ、37℃ で一晩培養する。
実験に使う試薬
簡単なフィルターを通した水道水を蒸留し、イオン交換樹脂で脱イオンしたものを
もう一度蒸留する。これを再蒸留水という。再蒸留水をミリ Q ラボという装置
(ミリポア社製)でさらに脱イオンする。(水の中のイオンはほとんど取り除かれ
電気抵抗が 1 cm あたり 18 MΩ 以上になる。)これをミリ Q 水(超純水)という。
ミリ Q 水をオートクレーブ滅菌したものを滅菌水と呼んでいる。分子生物学用
や細胞培養にはこのような純粋な水を使う。
T4 polynucleotide kinase が DNA の 5' 末端に付加するリン酸は ATP 由来である。(c) T4 polynucleotide kinase
ATP のリン酸基を DNA あるいは RNA の 5' 末端の水酸基に転移する反応を(d) T4 DNA polymerase
触媒する酵素。今回のような用途の他、放射性の ATP を利用して、プローブの
末端標識などに使われることも多い。
T4 DNA polymerase は、5'→3' のポリメラーゼ活性の他に、1 本鎖および 2 本鎖(e) T4 DNA ligase
の DNA に対する、強い 3'→5' exonuclease 活性を持っている。この酵素は
直鎖状 2 本鎖 DNA の末端の平滑化に汎用される。
隣接した DNA の 5' 末端のリン酸基と 3' 末端の水酸基を連結してホスホジエステル
結合を作る酵素。Mg2+ と ATP を要求する。RNA どうし、あるいは RNA と DNA の
連結はほとんどできない。最適温度は 37℃であるが、熱に弱い酵素なので、長時間
反応させたい場合には低めの温度で反応を行わなければならない。