海洋生命・分子工学実験 II
(4) ライゲーションとトランスフォーメーション
みんなのデータ
はじめに
さて,いよいよ,ゲルから精製した mCherry cDNA 断片と pBluescript II SK+ ベクターを
連結して環状プラスミドを完成させます。どのようなプラスミドになるかは (0) を見て考え
ましょう (web テキストのようなマップや,連結部分の塩基配列を,自分の手で紙に書いて
みること!)。 DNA や RNA の 5' 末端のリン酸基と 3' 末端の OH 基を連結して
リン酸ジエステル結合を生じる化学反応をライゲーション (ligation) といいます (図 1)。
図 1: 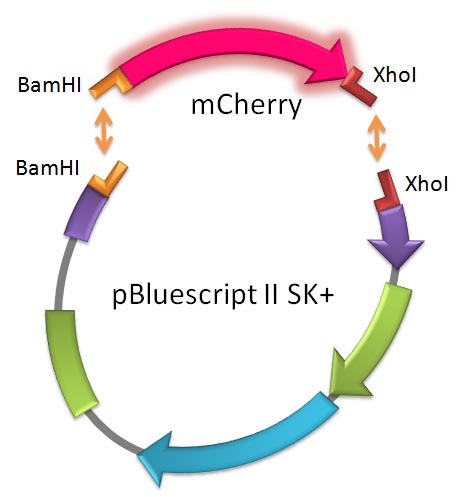
ライゲーションは,付着末端どうしの間で塩基対合を形成することではないので注意。
プラスミドを組み立てたら,それを大腸菌に導入します。この操作を大腸菌の形質転換
(トランスフォーメーション) といいます。
知っておかなければならないこと
cDNA とプラスミドの連結に使うのは T4 ファージ由来の T4 DNA ligase という酵素です。この
酵素が触媒する反応は,末端の形状が同じ DNA どうしの塩基対形成ではありません。DNA
(または RNA)鎖の 5' リン酸基と、3' 水酸基を結合させる・・・すなわち DNA のリン酸
ジエステル結合を作る反応です(「分子遺伝学」 を復習しよう)。この実験では,Promega 社で
売っている反応バッファー (2x Rapid Ligation Buffer) を使います。このバッファーの組成は
[60 mM Tris-HCl (pH 7.8),20 mM MgCl2,20 mM DTT,2 mM ATP,10% ポリエチレン
グリコール #8000] です。通常は,室温で 1 時間程度,または 4-16℃ 程度で 4‐16 時間ほど
反応させます。T4 ファージが感染した大腸菌の細胞内では,酵素は 37℃ 付近で働きます。
実際 37℃ で反応させた方が速いのですが,酵素の熱安定性が低いので早く失活してしまいます。
そこで低温で反応させるわけです。
今回のように 2 種類の DNA 鎖を連結したい場合,DNA 鎖どうしが出会う確率が高いほど
ライゲーションの効率が高くなります。反応液にポリエチレングリコールが入っていますよね。
このように “場所をとる” ポリマー分子を高濃度で混ぜておくと,溶液の全容量の中で DNA が
動き回れる “スペースが非常に狭く” なり,ライゲーション効率が上がるのです。
今回のライゲーションではプラスミドを BamHI
と XhoI で切断してあるので,プラスミド断片
の両末端の形状が違います。したがって “切れなかった” とか “片方の酵素でしか切れなかった”
というような “切れ残り” がない限り,1 本のプラスミドの両端が cDNA を挟まずに連結して閉じて
しまうこと(セルフライゲーションという)はありません。また cDNA どうしが結合することもありま
せん。したがって,連結後に環状になったプラスミドは高率で cDNA を挟みこんでいることが期待
されます。
次に,ライゲーション反応後の環状プラスミドを大腸菌に導入します。バクテリオファージは
ゲノム DNA を包み込む殻やいわゆる”足”の部分を持っていて,大腸菌の細胞表面タンパクと
結合して “自力で” 感染することができますが,プラスミドは殻を持たない裸の DNA なので,
放っておいても大腸菌には入りません。そこで,大腸菌の細胞壁や細胞膜にちょっとダメージ
を与えておいて,そこにプラスミドを加えることによって(ファージが感染するのに比べれば非常
に低い頻度で)プラスミドを大腸菌に取り込ませます。一旦取り込まれれば,プラスミドは大腸菌の
増殖に伴って複製し,増えることができます。この操作は大腸菌の形質転換 (トランスフォー
メーション) といいます。これは,大腸菌ゲノムに本来存在しない外来遺伝子を導入することに
よって大腸菌の形質を変えるということを意味します。研究室では,よく 「プラスミドを大腸菌に
トランスフォーメーションする」 といった表現を使っている人がいますが,これは言葉の使い方と
しては誤りです。「大腸菌をプラスミドでトランスフォーメーションする」 のです。注意してください。
大腸菌の表面にダメージを与える方法はいろいろありますが,この実験では既にそういう処理を
施されたうえで生きたまま凍結保存されている大腸菌 (competent cells という) を使います。
この方法はちょっと面倒なので実習ではその作業は省略します。みんなは,もらった competent
cells にライゲーション反応液を添加して寒天プレートにまくだけです。寒天プレートには大腸菌の
生育に必要な栄養分の他に,抗生物質アンピシリンが添加されています。プラスミドを取りこんだ
菌は,プラスミドの持つアンピシリン耐性遺伝子のコードする β‐ラクタマーゼ の働きにより
アンピシリン入り培地の上で増殖できますが,プラスミドを取りこまなかった菌はすぐに死んで
しまいます。したがって,一晩おいた後にプレート上にできた菌のコロニーは,みなプラスミドを
持つ大腸菌であるというわけです。もしもアンピシリンを含まない培地にまいたら,プレート全体に
菌が生えてしまいます。
実験
2 人 1 組で実験を行います。
1.
0.5 ml チューブに,Easy Trap で回収した mCherry cDNA 断片と pBluescript II
SK+ 断片を入れ,合計 2 μL になるように滅菌水を加える。
注: 両方の断片の混合比率は,EasyTrap 後のアガロースゲル電気泳動のバンドの
強さが同じ程度になるようにするとうまく行きます。
2. 以下の試薬を加えて反応液を作る。
2x ライゲーションバッファー (Promega)
|
2.5 μL
|
| T4 DNA ligase (Promega) |
0.5 μL
|
3. 室温で 30 分間反応させる。
4. 大腸菌の competent cells (a) 30 μL に対して,ライゲーション反応液を 3 μL
加える。
注: 混ぜないでください。激しく振り混ぜたりボルテックスをすると competent cells は
死にます。
5. Competent cells とライゲーション反応液の混合液を氷中に 20 分おく。
6. 混合液を 42℃ で 1 分 30 秒加熱処理する。
7. 500 μL の LB 培養液 (b) を加え,37℃ で 30 分振盪する。
8. 全量を LB/amp 寒天培地 (c) にまき,スプレッダー (d) で塗りひろげる。
9. 37℃ で一晩(コロニーが十分大きくなるまで)培養する。
実験に使う試薬と器具
(a) Competent cells
Competent cells
の作製法はたくさんあるが,今回使う competent cells は
Hanahan
法で調製した。菌の系統としては,タンパク質発現用のものではなく,通常の遺伝子
クローニングに使う
DH5α を使う予定。
(1) 大腸菌を 1.5 mL の
LB (b) 培養液で一晩培養する(37℃)。
(2) 2 L 用のフラスコに 200 mL の
SOB (e)
培養液を用意し,一晩培養した大腸菌を
1 mL 入れる。
(3) 泡立たないようにゆるやかに振盪しながら 37℃ で培養する。
(4) 2〜2.5 時間、550 nm の吸光度が 0.6 になるまで培養する。
注) 吸光度が 0.65 を超えないように。
(5) 10 分間、氷冷する。
(6) 全量を
6,000 rpm で 5 分間遠心する(4℃ で)。
(7) 上清を捨てて、沈殿を、氷冷しておいた 70 mL の
TfbI (f)に懸濁する。
(8) 氷につけて 10 分おく。
(9) 6,000 rpm で 5 分間遠心する(4℃ で)。
(10) 上清を捨てて、沈殿を、氷冷しておいた 16 mL の
TfbII (g)に懸濁する。
(11) 氷につけて 15 分おく。
(12) エッペンチューブに 100〜200 μL ずつ分注する。
(13) ドライアイスを入れて冷やしたエタノールにつけて急速に凍結する。
(14) -80℃ で保存する。
(b) LB 培養液
[1% トリプトン(タンパク質の加水分解物)、0.5% 乾燥酵母エキス、1% NaCl]
粉末を蒸留水に溶かしてオートクレーブ滅菌した後,冷えたら必要に応じて抗生物質を
加える。pH を 7 に合わせることになっているが,実際には粉を溶かしただけの pH 6.5
前後で大腸菌はよく増殖する。
(c) LB/amp 寒天培地
この実験では 50〜100 μg/mL アンピシリンを含む LB
培地 (LB/amp ) を使う。
LB 培地の作り方は上記 (b)
のとおりであるが,粉末を水に溶かした後、最終濃度 1.5%
の精製寒天抹を加え(振り混ぜない),オートクレーブ滅菌する。オートクレーブをすると
寒天が溶けるので,この段階でよく振り混ぜて均一にする。寒天が固まらない程度に
冷めてきたらアンピシリンを加えてよく混ぜ,プラスチックシャーレにまいて固める。
今回の
実験ではプラスミドがアンピシリン耐性遺伝子を持つのでアンピシリン入り培地を作ったが
プラスミドがカナマイシン,テトラサイクリンなど別の抗生物質耐性遺伝子を持つ場合は
それに応じて適当な抗生物質を加える。
(d) スプレッダー
これ ⇒

ガラス棒を加熱して,まげて作る。
[2% トリプトン,0.5% 乾燥酵母エキス,10 mM NaCl,2.5 mM KCl] を溶かしてオートクレーブ
滅菌をする。それとは別に 1 M
MgCl2 と 1 M MgSO4 を作って滅菌しておく。オートクレーブ
後の培地にそれぞれ
1/100 量ずつ加える(最終濃度が各 10 mM になるように)。
(f) TfbI
[30 mM KOAc,100 mM RbCl,10 mM CaCl2,50 mM MnCl2,15% グリセリン]
酢酸を用いて pH を 5.8 に調整した後,ろ過滅菌をする。
(g) TfbII
[10 mM MOPS,75 mM CaCl2,10 mM RbCl,15% グリセリン]
KOH を用いて pH を 6.5
に調整した後,ろ過滅菌する。
遺伝子工学的実験法の目次へ戻る
 ガラス棒を加熱して,まげて作る。
ガラス棒を加熱して,まげて作る。
 ガラス棒を加熱して,まげて作る。
ガラス棒を加熱して,まげて作る。