こちらから
メンブレン(ニトロセルロース)についてはこちら。 リンク先のページに進み,お問い合わせフォームのすぐ上の
「詳細情報」を 表示させ,さらに,「補足イメージ」をクリックすると,メンブレンの構造が見えます。
分子量マーカ
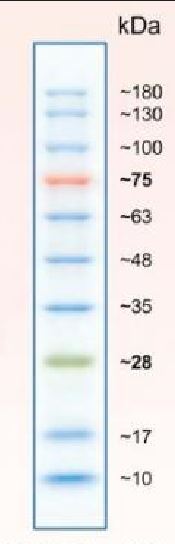 2023.6.29 今回のマーカーに写真を差し替えました。
2023.6.29 今回のマーカーに写真を差し替えました。 V--大腸菌で発現する Vasa タンパク質の塩基配列,アミノ酸配列情報はこちら
N--大腸菌で発現する Nanos タンパク質の塩基配列,アミノ酸配列情報はこちら
P--大腸菌で発現する PCNA タンパク質の塩基配列,アミノ酸配列情報はこちら
↑このファイルは,SnapGeneViewer がインストールされていないと開けません。
(2 年生の化生実験 II のなかで,山﨑先生のメニューで使ったアプリケーションです。)
■実験で使った試薬の組成
こちらから
メンブレン(ニトロセルロース)についてはこちら。 リンク先のページに進み,お問い合わせフォームのすぐ上の
「詳細情報」を 表示させ,さらに,「補足イメージ」をクリックすると,メンブレンの構造が見えます。
分子量マーカ

■実験結果
メンブレンへの転写の結果はこちら
ウェスタンブロッティングの結果はこちら
■実験結果の解説
タンパク質を転写したメンブレンをポンソーS で染色したあとの写真を見てみましょう。今年は残念ながら,こちらの狙い通りの染色像とは
なっていませんでした。(ただ,実際のメンブレンを見に来た人は,肉眼で見えたと思います。) 理想的な写真に近いモノを昨年(2022 年)から
借りてきて,ページの下の方に「おまけ2」として載せています。ここで,皆さんに実感,理解してもらいたかったことが 2 つです。
(1つ目)ゲルからメンブレンにタンパク質が転写されたかどうかを判断する
この点については,今回のように色のついたマーカーを使っている場合,そのマーカーがメンブレンに移っているかどうかで判断することができます。
どうでしょうか? ちゃんとメンブレンにマーカーが見えてますね? マーカーがうまく転写されているならその隣にいるサンプルも(無色で見えないけど),
転写されているはず,と判断して免疫染色に進んでもよいです。 ただし,「おまけ1」の写真を見てください。転写後のゲルの写真です。大きな分子量側
のマーカーが何本かゲルに残っているのが分かりますね?これは,今回の条件では,高分子量側の転写効率が少し悪かった,と見ます。
研究の現場なら,「満足できるまで転写の条件を変えて再トライ!」となります。
この実習では,ポンソー S で染色して,メンブレンにあるタンパク質を染色しました。その結果,わずかな数のバンドが見えていますね。
なので,この結果から,転写が成功したか,失敗したかの 2 択ならば,,成功したと判断することができます。
(2つ目)メンブレンには,数千種類のタンパク質がくっ付いている(ゲルから転写されている)ことを理解する
この点については,メンブレンにあるタンパク質を染色してみないと分かりません。だから,ポンソー S で染色しました。数千本とはいきませんが,
たくさんのバンドが写真でも見えたら良かったのだけど,数本しか映っていません。この写真からは,見えているバンドの分しかタンパク質がない,,ということ
ではなくて,タンパク質が少なくて,ポンソー S 染色の染色感度では目に見えるほどに強く染まらなず,沢山あるのだけど見えていない,と判断してください。
「おまけ2」の写真を見れば,砂長が言いたいことが理解できるはずです。
今回は前回よりも多くの液量をサンプルとして電気泳動に使いましたね。砂長のあてにならない勘と説明したものです。今回は,前回に比べ,タンパク質
抽出液に含まれるタンパク質濃度が低かったことが予想されます。もっと,泳動する液量を増やしても良かったかもしれません。 けれど,多すぎれば別の
トラブルにもつながるので,判断が難しいところですね。
免疫染色の結果を見てみましょう。スキャナで取り込んで,発色が見えるように,photoshop というソフトで編集しています。肉眼でメンブレンを見たときよりも
バンドがよく見えるようになったかも。その代わりに余計な汚れや影も現れてしまっているところもあります。
X,Y,Z が何なのかは,,ホントは分析してもらおうと思っていたけども,,,以下の通り。
X--- ホヤの Vasa 遺伝子を発現させた大腸菌サンプル
Y--- ホヤの Nanos 遺伝子を発現させた大腸菌サンプル
Z--- ホヤの PCNA 遺伝子を発現させた大腸菌サンプル
C--- ただの大腸菌
| グループ | |||
| 1 | X | Y | |
| 2 | Y | Z | |
| 3 | X | Z | |
| 4 | X | Z | |
| 5 | X | Z | |
| 6 | X | Y | |
| 7 | Y | Z | |
| 8 | X | Z | |
2 班と 7 班の結果を見ます。当初の想定は,Nanos と PCNA を大きさで見分けるつもりでしたが,ちょっと無理そうです。隣り合わせにあれば分かるかな,,
と思って,今年,初めて実習のサンプルにしてみましたが,あてが外れました。なので,今回は,実習時間中に答えを教えました。
Y と Z は,一次構造から予測される分子量に近い位置にバンドが現れたように見えます。X は,なんか「あれ?」て感じですね。
C のサンプルには,今回使った一次抗体の抗原となるタンパク質がないはずなので,免疫染色しても何も染まらないはず,と予想できます。
こちらは予想通りになったでしょうか?
ところで,この C サンプルは何のために作業したんだっけ? なぜ,「何も染色されない」という当たり前の結果が出ると分かっている実験をやったのでしょうか?
これは,科学の実験で大変重要な作業で,[コントロール実験,対照実験] と呼びます。実験で使う抗体に対する抗原が含まれていない,と分かっているサンプルに
対して免疫染色をする。その結果,何も検出されないことが重要なのです。
見方を変えて,こんな場合を考えてみてください。X か Y か Z のサンプルをブロットしたメンブレンで 予想通り の位置にバンドが検出されたとします。
けど,そのバンドが,C でも検出されてしまったら,,, そうなると,見えたバンドは,抗体が抗原に特異的に結合したことで見えたバンドなのかどうか,
怪しいですね。 抗体が別のタンパク質に結合しやすいのかも? 実験操作が正しかっただろうか? という具合に,結果をそのまま信じて,考察してよいのか?
と疑わなければなりません。
同じ条件で、同時に作業したコントロールサンプルの結果を併せて示すことで,結果として現れたタンパク質のバンドが,使った抗体によって 特異的に検出された
結果だと強く主張できるわけです。 もし,C でもバンドが見えたとなると,,,抗体は特異的か?2 次抗体が大腸菌のタンパク質に結合したのかも??
実験の手順は間違いないか? さまざまな可能性を考えなければなりません。
さて,
皆さんのレポートには,実験結果として見えた通りの結果を記述して下さい。見えた通りに示すのが「結果」です。自分でとった写真を使う
場合はその写真の通りに。このHPの写真を使うのなら,その写真の通りに記述して下さい。ほんとは,こういうバンドがでていた,,,というような
書き方はダメです。レポートに使う写真と説明,記述は,一致させてください。
考察はあってもなくてもいいです(あれば加点対象)。その代わりに,以下の課題に取り組んでください。
●課題●
次の①と②は,免疫染色してみたら予想に反するバンドが出てしまって,その理由を考えくてだい,,という問いです。
皆さんは,①と②で別々の理由を考えて説明してください。例えば,①の説明のあとに,「②も同様の理由で余計なバンドが出た」
というレポートならこの課題の評価は 0 点です。
①と②では,同じような実験だけど,違っていることがあるので,そのあたりからじっくり考えないと,納得のいく説明ができません。
①で説明した理由を②に当てはめてみて,矛盾していないか,,は自分で確認しましょうね。
問題
① 皆さんの実習で X のサンプルでは,どうみても複数のバンドが現れていますね。 なぜそうなったか,理由を説明してください。
② 砂長研究室には,「抗ホヤ Vasa タンパク質モノクローナル抗体」があります。2008年に,学術論文のなかで,この抗 Vasa モノクローナル抗体を
作製したことを報告しました。論文では,下のようなウエスタンブロットの結果を載せました。 論文の実験では大腸菌ではなく ホヤ からタンパク質
を抽出し,Vasa タンパク質を検出しました。ホヤの Vasa タンパク質については Vasa 遺伝子の塩基配列をもとにアミノ酸配列が分かっており,
そこからタンパク質の質量を予測することができます。予測された分子量は 74 kDa だったので,作製した抗体は,きちんとミダレキクイタボヤの
生体に存在する Vasa タンパク質に結合する(写真の矢尻のところのバンド)と報告しました。
ところが!,論文の審査員から 「42 kDa くらいにバンド(*印)が見える!これが何なのかちゃんと説明しなさい,その抗体は Vasa タンパク質
以外にも結合してしまうのではないのか?」というコメントが来ました。
ということで,ここでのレポート課題は,この質量 42 kDa くらいのバンドがでてしまった理由を考えて下さい。
 ←論文に載せた写真
←論文に載せた写真
★注意点
この課題には,決まった 1 つの答えがあるわけではありません。それぞれ結果の写真にたどり着くまでの実験過程,
(タンパク質の精製方法や抗体が出来る仕組み,モノクローナル抗体の作り方,ウェスタンブロッティング etc..)を考えて,
どこでどんなことがおこった結果,余計なバンドがでたのか?その可能性を考えてみてください。
重要なのは,きちんと論理が通っていることです。また,「何かの手違いがあった とか 実験が下手くそだから」というような
一言で済ますのもだめ(点数あげない)。 よーーーく 考えて,書いてください。
疑問がある人は遠慮なく砂長まで相談してください。無論,正解そのものは教えませんけどね。
再度,書きますが,満点をあげる答えがいくつかあると思います。