各グループの total RNA 水溶液をアガロースゲルで電気泳動した。M のレーンで泳動したマーカーは,二重鎖 DNA のマーカーであるため,
RNA の鎖長を判定する物差しとしては使えないので注意すること。
ただし,光の強さ(白くみえる部分)はそこにある核酸の量を反映していると考えてよい。強い光,太いバンドはそれだけ核酸の量が多い。
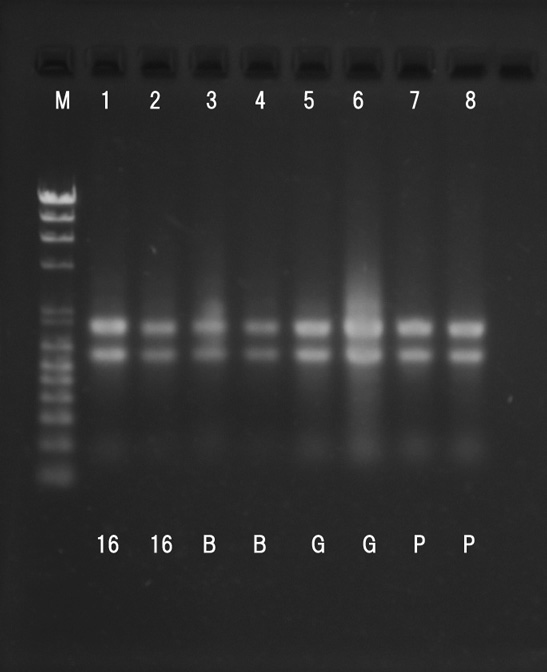
※ 1,4,5,8 班の RNA から作製した cDNA を RT-PCR の鋳型として使用した
★ 結果 ★
-吸光度測定による定量および純度測定
測定のために超純水で希釈( 8 倍希釈)しましたが,器械に希釈率を登録して測定したので,表示の数値が 原液の RNA の濃度になります。
以下の値は,機器(バイオフォトメータ)に表示された値である。
| . | . | 値 1 回目 | 値 2 回目 | 発生段階 | 電気泳動量 |
| 1 班 | 濃度 (ug/uL) | 0.550 | 0.557 | 16 細胞期 (16) |
0.5 ug 計算.. |
| A260/A280 | 1.77 | 1.78 | |||
| 2 班 | 濃度 (ug/uL) | 1.067 | 1.072 | ||
| A260/A280 | 1.99 | 1.98 | |||
| 3 班 | 濃度 (ug/uL) | 1.148 | ---- | 胞胚期 (B) |
|
| A260/A280 | 1.86 | ---- | |||
| 4 班 | 濃度 (ug/uL) | 1.346 | 1.362 | ||
| A260/A280 | 1.81 | 1.83 | |||
| 5 班 | 濃度 (ug/uL) | 0.808 | 0.796 | 原腸胚期 (G) |
|
| A260/A280 | 1.96 | 1.92 | |||
| 6 班 | 濃度 (ug/uL) | 0.710 | 0.720 | ||
| A260/A280 | 1.92 | 1.94 | |||
| 7 班 | 濃度 (ug/uL) | 0.078 | 0.078 | プルテウス幼生 (P). |
|
| A260/A280 | 1.93 | 1.92 | |||
| 8 班 | 濃度 (ug/uL) | 0.123 | 0.123 | ||
| A260/A280 | 2.00 | 2.01 | |||
| . | . | . | . | . | . |
-アガロースゲル電気泳動
各グループの total RNA 水溶液をアガロースゲルで電気泳動した。M のレーンで泳動したマーカーは,二重鎖 DNA のマーカーであるため,
RNA の鎖長を判定する物差しとしては使えないので注意すること。
ただし,光の強さ(白くみえる部分)はそこにある核酸の量を反映していると考えてよい。強い光,太いバンドはそれだけ核酸の量が多い。

※ 1,4,5,8 班の RNA から作製した cDNA を RT-PCR の鋳型として使用した
★ レポート作成のポイント
実験結果の説明として,上記の吸光度計での測定値と電気泳動写真を使用し,抽出した RNA のクオリティチェック (QC)を自分たちで
やってみてください。
自分たちの班の RNA の品質を中心に述べるのが基本ですが,他班の結果も材料にして,濃度と電気泳動像のつじつまが合っているか
どうかなど,考察してみてください。A260/A280 とは何なのか?調べてみると一段深い考察ができるかもしれません。
★ 課題1
今回の実習でやったアガロースゲル電気泳動では,TAE バッファーにアガロース(1% w/v)を溶かして,型に流し込み,冷やして固めたゲルを使い,
TAEバッファー中で電気泳動しました。しかし,この方法では,RNA を正しく鎖長ごとに分離することができません。
そこで,この課題では,,「正しい方法」を自学で理解してもらいます。RNA をゲル電気泳動で分離する正しい方法について,説明してください。
ただし,「○×○×法」のように単語で答えるのではなく,RNA の性質などについても触れながら,手順や使われる試薬などが
「何ための手順なのか?」「その試薬にどんな効果があるのか?」が分かるように,でもなるべく簡潔に記述してください。
2) 逆転写反応による cDNA 合成へ
3) RT-PCRへ
TOPへ