2‐8. 制限酵素による挿入 DNA 断片のチェック
はじめに
前の実験で調製したプラスミド DNA を制限酵素で切って電気泳動してみます。
正しい形に組み立てられているプラスミドならどう切れるか(?)、セルフライゲーション
していたらどう切れるか(?)、など、考えられるいくつかのパターンを想定し、
電気泳動したときにそれらのバンドのパターンから自分の拾ったコロニーが
”本物の”プラスミドを持っているのかどうかを、ある程度知ることができます。
知っておかなければならないこと
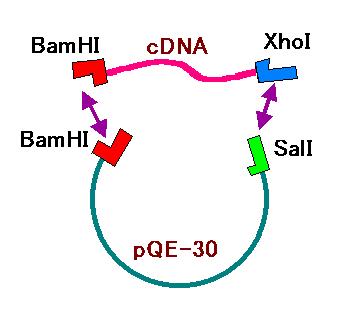
組み込むときに使った制限酵素で再び同じ箇所を切って、cDNA とプラスミドの
両方のバンドがきちんと出てくるかどうかを見るというのが一番わかりやすい
方法の一つです。しかし、2‐6 で行った実験では cDNA とプラスミドの連結部の
一方は XhoI 切断部位と SalI 切断部位の結合であり、できあがった配列は
[CTCGAC] となっています。この配列は、もはや XhoI
でも SalI でも切ることが
できません(図 1 参照)。
図 1

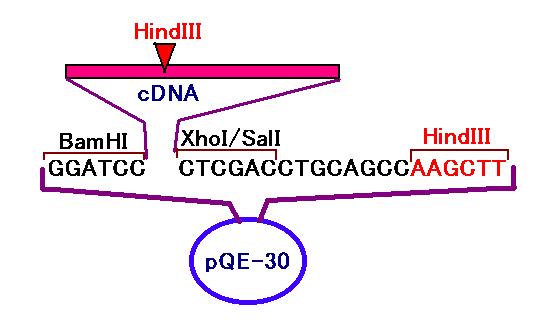
そこで、ここではできあがった(はずの)プラスミドを HindIII
で切ってみましょう。
HindIII は [AAGCTT] という配列を切る制限酵素です。
HindIII の認識配列は、pQE‐30 プラスミド上では、SalI 認識配列の直後にあります
(図 2)。また、cDNA の塩基配列(2-3 のヘモグロビンの塩基配列参照)の中では、
翻訳開始点から下流約 200 塩基あたりに 1 箇所だけあります(図 2)。それ以外の
場所にはありません。今回の実験でプラスミドに組み込んだヘモグロビン cDNA の
全長は約 630 bp ですから、もしも正しく組み立てられたプラスミドを HindIII で
切断すると、上記の 2 ヶ所で切れてプラスミド本体に cDNA の上流側約 200 bp を
足した約 3.6 kb の大きな断片と、cDNA の下流側約 430 bp にほんのわずかの
プラスミドの配列(XhoI と SalI の連結部から HindIII まで)を含む、約 450 bp
の
短い断片の 2 本の断片を生じるはずです。
(もしも cDNA 断片を挟まずにセルフライゲーションしたプラスミドがあったとしたら
それを HindIII で切ったときにどのような断片を生じるでしょうか?)
図 2
実験
前の実験で精製したプラスミド DNA を使う。1. 制限酵素溶液を調製する。
以下の試薬(5 人分である。これを 4 人で使う)を混ぜる。
滅菌水を 12.5 μl
10x 制限酵素バッファー2 を 5 μl
[100 mM Tris-HCl (pH 7.9), 500 mM NaCl, 100 mM MgCl2,
10 mM DTT]
1 mg/ml ウシ血清アルブミンを 5 μl
HindIII を 2.5 μl
2. 制限酵素溶液を 1 本のエッペンに 5 μl ずつ分注する。
1 人 1 本使う。3. RNase A 処理済みのプラスミドを 5 μl とって、制限酵素溶液に
加えてよく混ぜる。
4. 37℃ ウォーターバスで 1 時間反応させる。5. 反応液に 6x 色素溶液を 2 μl 加え、アガロースゲル電気泳動
を行う。
6. バンドのパターンを確認する。